Sadržaj
- Paramagnetski naspram dijagnostičkih elemenata
- Izračunavanje je li element paramagnetni ili dijamagnetski
- Popis paramagnetnih atoma
- Paramagnetni spojevi
Svi atomi na neki način reagiraju na magnetska polja, ali različito reagiraju ovisno o konfiguraciji atoma koji okružuju jezgru. Ovisno o ovoj konfiguraciji, element može biti dijamantski, paramagnetski ili feromagnetski. Elementi koji su dijamagnetski - što su zapravo i svi, do određene mjere - slabo ih odbija magnetsko polje, dok paramagnetni elementi slabo privlače i mogu se magnetizirati. Feromagnetski materijali također imaju mogućnost magnetiziranja, ali za razliku od paramagnetnih elemenata, magnetizacija je trajna. I paramagnetizam i feromagnetizam jači su od dijamagnetizma, tako da elementi koji pokazuju ili paramagnetizam ili feromagnetizam više nisu dijamagnetizirani.
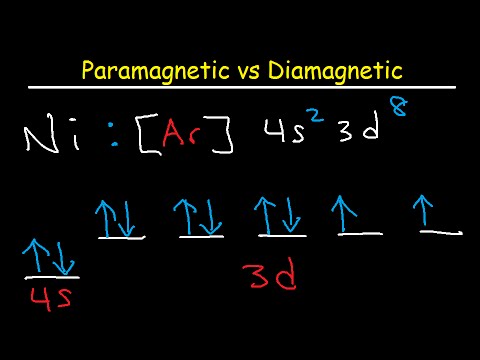
Samo je nekoliko elemenata feromagnetsko na sobnoj temperaturi. Oni uključuju željezo (Fe), nikal (Ni), kobalt (Co), gadolinij (Gd) i - kako su nedavno otkrili znanstvenici - rutenij (Ru). Pomoću bilo kojeg od tih metala možete napraviti trajni magnet izlaganjem magnetskom polju. Popis paramagnetnih atoma mnogo je duži. Paramagnetski element postaje magnetski u prisutnosti magnetskog polja, ali gubi svoja magnetska svojstva čim ga uklonite. Razlog takvog ponašanja je prisutnost jednog ili više nesparenih elektrona u vanjskoj orbitalnoj ljusci.
Paramagnetski naspram dijagnostičkih elemenata
Jedno od najvažnijih otkrića u znanosti tijekom posljednjih 200 godina je međusobna povezanost električne energije i magnetizma. Budući da svaki atom ima oblak negativno nabijenih elektrona, on ima potencijal za magnetska svojstva, ali pokazuje li feromagnetnost, paramagnetizam ili dijamagnetizam, ovisi o njihovoj konfiguraciji. Da biste to shvatili, potrebno je razumjeti kako elektroni odlučuju koju orbitu zauzimaju oko jezgre.
Elektroni imaju kvalitetu nazvanu spinu koju možete zamisliti kao smjer rotacije, iako je njegova složenija od toga. Elektroni mogu imati "spin-up" (što možete zamisliti kao rotaciju u smjeru kazaljke na satu) ili "spin-up" (u smjeru suprotnom od kazaljke na satu). Oni se raspoređuju na povećanju, strogo definiranih udaljenosti od jezgre koje se nazivaju ljuske, a unutar svake ljuske nalaze se podsupljeće koje imaju diskretni broj orbitala koje mogu zauzeti maksimalno dva elektrona, a svaka ima suprotni spin. Kažu da su upareni dva elektrona koja zauzimaju orbitu. Spinovi im se ukidaju i ne stvaraju neto magnetski trenutak. Jedan elektron koji zauzima orbitalu, s druge strane, nije uparen, a to rezultira neto magnetskim trenutkom.
Dijagnostički elementi su oni bez neparnih elektrona. Ti se elementi slabo suprotstavljaju magnetskom polju, što znanstvenici često pokazuju levitatiranjem dijamagnetskog materijala, poput pirolitnog grafita ili žabe (da, žaba!) Preko jakog elektromagneta. Paramagnetni elementi su oni koji imaju nesparene elektrone. Daju atomu neto magnetski dipolni moment, a kada se primijeni polje, atomi se poravnavaju sa poljem, a element postaje magnetski. Kada uklonite polje, toplinska energija intervenira kako bi se nasumično raspoređivali, a magnetizam se gubi.
Izračunavanje je li element paramagnetni ili dijamagnetski
Elektroni ispunjavaju ljuske oko jezgre na način koji minimalizira neto energiju. Znanstvenici su otkrili tri pravila koja se drže pri tome, poznata kao Aufbrau-ovo načelo, Pravilo Hunds-a i Pauli-ovo načelo isključenja. Primjenjujući ova pravila, kemičari mogu odrediti koliko elektrona zauzima svako podproljeće koje okružuje jezgro.
Da bi se utvrdilo je li neki element dijamagnetski ili paramagnetni, potrebno je pogledati samo valentne elektrone, koji su oni koji zauzimaju najudaljeniju podkolu. Ako najudaljenija potkoljenica sadrži orbitale s parnim elektronima, element je paramagnetski. Inače, njegov dijamagnetni. Znanstvenici identificiraju podsupljeće s, p, d i f. Pri pisanju konfiguracije elektrona, konvencija je prethoditi valentnim elektronima plemenitim plinom koji prethodi predmetnom elementu u periodičnoj tablici. Plemeniti plinovi su u potpunosti ispunili elektronske orbitale, zbog čega su inertne.
Na primjer, konfiguracija elektrona za magnezij (Mg) je 3s2, Vanjska potkoljenica sadrži dva elektrona, ali oni su neparni, pa je magnezij paramagnetni. S druge strane, elektronska konfiguracija cinka (Zn) je 4s23d10, U svojoj vanjskoj ljusci nema neuparenih elektrona, pa je cink dijamagnetski.
Popis paramagnetnih atoma
Magnetska svojstva svakog elementa mogli ste izračunati tako da napišete njihove elektronske konfiguracije, ali na sreću to ne morate. Kemičari su već stvorili tablicu paramagnetnih elemenata. Oni su kako slijedi:
Paramagnetni spojevi
Kada se atomi kombiniraju da tvore spojeve, neki od tih spojeva mogu također pokazati paramagnetizam iz istog razloga kao i elementi. Ako jedan ili više neparnih elektrona postoji u orbitalima spojeva, spoj će biti paramagnetski. Primjeri uključuju molekularni kisik (02), željezov oksid (FeO) i dušični oksid (NO). U slučaju kisika, ovaj paramagnetizam moguće je prikazati jakim elektromagnetom. Ako sipate tekući kisik između polova takvog magneta, kisik će se sakupljati oko polova dok isparava stvarajući oblak plina s kisikom. Pokušajte isti eksperiment s tekućim dušikom (N2), što nije paramagnetsko i ne može se stvoriti takav oblak.
Ako želite sastaviti popis paramagnetnih spojeva, morali biste ispitati elektronske konfiguracije. Budući da su nespareni elektroni u vanjskim valentnim školjkama koji daju paramagnetske kvalitete, spojevi s takvim elektronima mogli bi se popisati. Ipak, to uvijek nije istina. U slučaju molekule kisika, postoji jednak broj valentnih elektrona, ali svaki zauzimaju niže energetsko stanje kako bi se umanjilo ukupno energetsko stanje molekule. Umjesto para elektrona u višoj orbitali, u donjim orbitalama postoje dva nesparena elektrona, što molekulu čini paramagnetskom.