Sadržaj
Kad dva elementa reagiraju, tvore spoj dijeljenjem, davanjem ili prihvaćanjem elektrona. Kad se dva bitno različita elementa vežu, poput metala i nemetala, jedan element kontrolira druge elektrone većinu vremena. Iako nije strogo točno reći da se dijeljenje ne događa, dijeljenje je toliko u prednosti u odnosu na jedan element, da se u sve praktične svrhe kaže da je njegov partner donirao ili „izgubio“ svoj elektron.
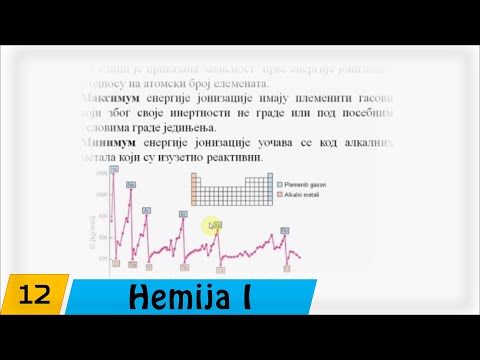
Elektronegativnost
Elektronegativnost opisuje tendenciju elementa da dobije elektrone. Ovaj je atribut formalno definirao Linus Pauling 1932. godine, koji je također razvio kvantitativno mjerenje elektronegativnosti koje se danas naziva Paulingova ljestvica. Elementi koji najvjerojatnije gube elektrone u reakciji su oni koji su najniži na Paulingovoj ljestvici, ili koji su najaktivniji. Budući da se elektronegativnost općenito povećava prelaskom iz donjeg lijevog ugla periodičke tablice u gornji desni kut, elementi na dnu grupe 1A padaju najniže na ljestvici, s cezijom i francijem koji bilježe 0,7. U skoro svakoj reakciji, alkalni metali iz grupe 1A i zemnoalkalijski metali u grupi 2A izgubit će elektrone svojim elektronegativnijim partnerima.
Jonske veze
Kada reagiraju dva elementa a sa značajnom razlikom u elektronegativnosti, nastaje ionska veza. Za razliku od kovalentne veze, u kojoj su oba atoma vanjski elektroni podijeljeni, elektropozitivniji element u ionskoj vezi gubi većinu svoje kontrole nad svojim elektronom. Kad se to dogodi, oba elementa se nazivaju "ioni". Element koji je izgubio svoj elektron naziva se "kation" i uvijek se prvo navodi u kemijskom nazivu. Na primjer, kation u natrijevom kloridu (kuhinjska sol) je natrij alkalnog metala. Element koji prihvaća elektron iz kationa naziva se "anion" i daje mu sufiks "-ide", kao u kloridu.
Redox reakcije
Element u svom prirodnom stanju ima jednak broj protona i elektrona, što mu daje neto naboj nula; međutim, kada element izgubi elektron kao dio kemijske reakcije, postaje pozitivno nabijen ili oksidira. Istodobno, element koji je uzeo elektron postaje negativnije nabijen, odnosno smanjen. Te se reakcije nazivaju redukciona-oksidacija ili „redoks“ reakcija. Zbog toga što donor elektrona ili oksidirani element uzrokuje redukciju drugog elementa, naziva se redukcijskim agensom.
Baze Lewisa
Baza Lewisa je svaki element, ion ili spoj koji izgubi nevezani par elektrona na drugi element, ion ili spoj. Budući da elektropozitivniji element uvijek gubi elektrone, to je vrsta koja postaje Lewisova baza. Napominjemo, međutim, da sve Lewisove baze u potpunosti ne gube elektrone; na primjer, kada se dva nemetala vežu, elektroni se često dijele, iako neravnomjerno. Međutim, kada metalna veza s nekovinskom metalom, rezultat je Lewisova baza s ionskom vezom, u kojoj je metal u sve praktične svrhe izgubio svoj par elektrona.