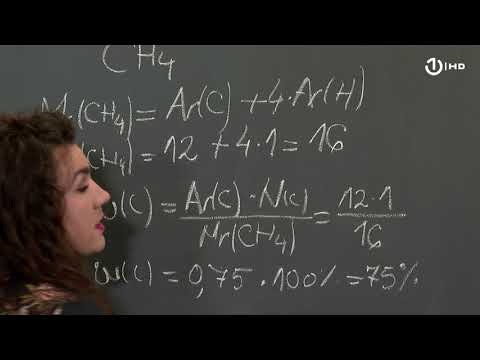
Kemičari koriste „krtice“, dobivene od njemačke riječi za molekulu, kao jedan od načina opisivanja količine kemijskog spoja. Dok jedinice poput grama ili kilograma opisuju masu kemikalije, moli opisuju broj čestica - bilo atoma, bilo molekula - tog spoja. Jedan mol jednak je vrlo velikom broju čestica: 6,02 x 10 ^ 23 njih. Možete naći molove bilo koje mase bilo kojeg spoja.
Zapišite molekularnu formulu spoja za koji izračunavate broj molova. Molekularna formula opisuje vrste elementarnih atoma i količine svake vrste koje se nalaze u molekuli spoja. Na primjer, molekularna formula vode je H2O, pokazuje da je svaka molekula vode načinjena od dva atoma elementa vodika i jednog atoma kisika.
Potražite atomsku težinu svake vrste atoma u formuli. Te se informacije nalaze u većini periodičnih tablica. Atomska masa kisika je 16,00, a vodika 1,008.
Pomnožite atomsku masu svakog elementa u spoju s količinom atoma tog elementa u formuli spojeva, a zatim dodajte sve rezultirajuće produkte. U slučaju vode, atomsku težinu vodika pomnožite sa dva, a atomsku masu kisika za jedan, a zatim dodajte proizvode. Brojčano bi to bilo (2) (1.008) + (1) (16.00) = 18.016. Ovo je molarna masa spoja; ima jedinica grama po molu.
Masu spoja podijelite u gramima s molarnom masom koju ste upravo izračunali. Odgovor je broj molova te mase spoja. Na primjer, 25 grama vode jednako je 25 / 18.016 ili 1,39 molova.