Sadržaj
- TL; DR (Predugo; nisam pročitao)
- Hibridizirane orbitale
- Sp Hibridizacija
- Sp2 Hibridizacija
- Sp3 Hibridizacija
- Viši stericki brojevi
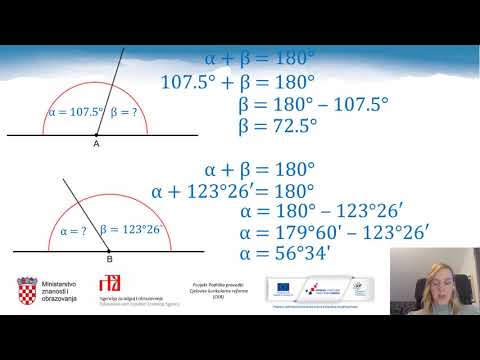
Predvidite kutove između vezanih atoma pomoću teorije odbijanja elektronskog para školjke (VSEPR). Sterijski broj - ukupno ostalih atoma i usamljenih elektronskih parova vezanih za središnji atom - određuje geometriju molekule. Usamljeni parovi elektrona nalaze se u vanjskoj (valan) ljusci atoma i ne dijele se s drugim atomima.
TL; DR (Predugo; nisam pročitao)
Iako ne možete koristiti VSEPR za izračun kutova veze, pomaže vam odrediti te kutove na temelju sterickog broja. Samo vodik ima stericki broj jedan, a molekula H2 ima linearni oblik.
Hibridizirane orbitale
Jedan elektron kreće oko atoma karakterističnog oblika koji je određen najvjerovatnijim mjestom za pronalaženje elektrona u bilo kojem trenutku. Elektroni se međusobno odbijaju jer svi imaju negativne naboje, pa orbitale daju svakom elektronu najveću moguću udaljenost od svojih susjeda. Kad valenski elektron formira kovalentnu vezu s drugim atomom, orbitala se mijenja u procesu koji se naziva hibridizacija. VSEPR predviđa kutove veze na temelju hibridiziranih orbitala, ali nije precizan za određene metalne spojeve, plinovite soli i okside.
Sp Hibridizacija
Najjednostavnija hibridna orbitala je sp, što odgovara sterickom broju dva. Kut veze je linearan, odnosno 180 stupnjeva, kada atom nema osamljenih parova elektrona. Primjer je ugljični dioksid. Suprotno tome, molekula dušika ima jedan usamljeni par elektrona. To mu daje linearni oblik, ali nehibridiziranu orbitalu i stoga nema kut veze.
Sp2 Hibridizacija
Sterijski broj tri dovodi do stvaranja sp2 orbitale. Kutovi veze ovise o broju parova usamljenih elektrona. Na primjer, triklorid bora nema osamljene parove, trokutni ravni ravni i kutovi veze od 120 stupnjeva. Molekul trioksigena O3 ima jedan usamljeni par i tvori savijeni oblik s kutovima veze od 118 stupnjeva. S druge strane, O2 ima dva usamljena para i linearni oblik.
Sp3 Hibridizacija
Atom sa stericnim brojem od cetiri moze imati od nula do tri usamljena para elektrona unutar sp3 hibridizirane orbitale. Metan, koji nema usamljene parove, tvori tetraedar sa kutovima veze 109,5 stupnjeva. Amonijak ima jedan usamljeni par, stvarajući kutove veze od 107,5 stupnjeva i trokutni piramidalni oblik. Voda, s dva usamljena para elektrona, ima savijeni oblik s kutovima veze 104,5 stupnjeva. Molekule fluora imaju tri para osamljenih i linearnu geometriju.
Viši stericki brojevi
Veći sterički brojevi vode do složenijih geometrija i različitih kutova veze. Uz VSEPR, komplicirane teorije poput polja molekularne sile i kvantne teorije također predviđaju kutove veze.