
Sadržaj
- TL; DR (Predugo; nisam pročitao)
- Kako izračunati molove
- Pretvaranje u Mmol
- Koncentracija otopine
- Primjer
Jednostavno, njihovi kemijski kemičari stvorili su standardnu jedinicu za broj atoma određenog spoja koji je uključen u reakciju ili neki drugi kemijski postupak. Oni definiraju jedan mol (mol) kao količinu bilo koje tvari koja ima isti broj osnovnih jedinica kao 12 grama ugljika-12, što je Avogadros broj (6.022 × 1023). SI (metrički) sustav mjerenja definira milimole (Mmol) kao tisućinu mola. Broj molova neke tvari obično izračunavate tako da odmjeravate količinu koja imate u ruci. Ako želite pretvoriti u Mmol, pomnožite sa 103 (1,000).
TL; DR (Predugo; nisam pročitao)
Jedan mol jednak je Avogadros broju čestica određenog spoja. Milimola (Mmol) je tisućina mola.
Kako izračunati molove
Atomske mase se mjere u jedinicama atomske mase (AMU). Jedna AMU je točno 1/12 mase jezgre ugljika-12 atoma u njegovom osnovnom stanju. Jedan mol tvari je određen da je jednak Avogadros broju čestica te tvari. Prema ovoj definiciji, težina jednog mola neke tvari u gramovima jednaka je broju pojedinačne čestice te tvari u AMU. Na primjer, atomska težina ugljika-12 je 12 AMU, tako da jedan mol ugljika-12 teži 12 grama.
Razmislite o spremniku punom vodikovog plina (H2). Svaka čestica u spremniku je molekula koja se sastoji od dva vodikova atoma, tako da za izračunavanje molekulske mase trebate znati samo atomsku masu vodika. Većina verzija periodične tablice navodi atomsku masu svakog elementa pod njegovim simbolom. Za vodik, koji u jezgri ima samo jedan proton, iznosi 1.008 AMU, što je prosjek svih prirodnih izotopa vodika. Prema tome, atomska masa vodikovog plina je 2.016 AMU, a jedan mol vodikovog plina teži 2.016 grama. Da biste pronašli broj molova u vašem uzorku, uzorak biste odmjerili u gramima i podijelili tu masu na molekulsku masu plina vodika u gramima. Na primjer, uzorak težak 15 grama čistog vodikovog plina sadrži 7,44 mola.
Pretvaranje u Mmol
Ponekad su količine pod istragom toliko male da ih je izražavanje u molovima nezgodno. Unesite milimole. Umnožavanjem broja molova na tisuću možete pretvoriti vrlo mali broj u upravljiviji. To je posebno prikladno kada se radi o jedinicama volumena redoslijedom mililitara.
1 mol = 1.000 Mmola
Koncentracija otopine
Kemičari koriste molarnost kao mjerilo koncentracije određenog spoja u otopini. Oni definiraju molarnost kao broj mola po litri. Pretvorite molarnost u milimolarnost množenjem sa 1.000. Na primjer, otopina od 1 mola (molarna, također napisana kao M) ima koncentraciju od 1 mola po litri. To je ekvivalent otopini od 1.000 Mmola (milimolarna, koja se ponekad naziva i mM), koja sadrži 1.000 Mmola po litri.
Primjer
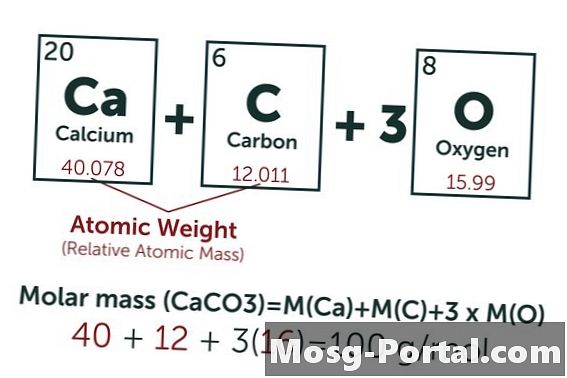
Otopina sadrži 0,15 grama kalcijevog karbonata. Koliko je to milimola?
Kemijska formula kalcijevog karbonata je CaCO3, Atomska masa ugljika (C) je oko 12 AMU, masa kisika (O) otprilike 16 AMU, a težina kalcija (Ca) približno 40 AMU. Svaka molekula kalcijevog karbonata teži 100 AMU, što znači da jedan mol teži približno 100 grama. Težina 0,15 grama predstavlja 0,15 g ÷ 100 g / mol = 0,0015 mola. To je ekvivalent 1,5 Mmola.
Kolika je molarnost i milimolarnost ovog toliko kalcijevog karbonata u 2,5 litre otopine?
Molarnost se definira kao broj molova po litri, pa podijelite broj molova na 2,5 da biste dobili molaritet: 0,0015 ÷ 2,5 =
0,0006 M
Pomnožite s 1.000 da biste dobili milimolarnost =
0,6 mM
Imajte na umu da ćete postići isti rezultat za milimolarnost ako podijelite broj milimola na volumen otopine.