Sadržaj
Većina atoma i molekula koje susrećemo električki su neutralni, ali ioni igraju važnu ulogu u prirodi. Ti nabijeni atomi mogu biti pozitivno nabijeni kationi ili negativno nabijeni anioni. Kationi i anioni se tvore na različite načine. Za katione gubitak elektrona ostavlja im pozitivan naboj, dok za anione dodavanje elektrona ostavlja im negativan naboj. Razumijevanje procesa koji stoje iza toga, uključujući energiju ionizacije i afinitet elektrona različitih atoma, pomaže vam da shvatite zašto određeni atomi postaju ioni lakše nego drugi i što uzrokuje to.
TL; DR (Predugo; nisam pročitao)
Kationi su pozitivno nabijeni ioni nastali kada atom izgubi elektron ionizacijom. Količina energije koja je potrebna za to naziva se energijom ionizacije
Anioni su negativno nabijeni ioni nastali kad atom dobije elektron. Energija u ovom procesu naziva se afinitet elektrona.
Što je ion?
Atomi imaju tri glavne komponente: protone, elektrone i neutrone. Neutroni su električno neutralni, i iako igraju važnu ulogu u nuklearnoj fizici, nisu bitni za stvaranje iona jer ne utječu na naboj atoma u kojem su. Protoni su pozitivno nabijeni i zauzimaju središnja jezgra atoma zajedno s neutronima. Elektroni su negativno nabijeni dio atoma i oni zauzimaju "oblak" oko vanjske jezgre. Elektroni i protoni imaju jednake, ali suprotne naboje, a u prirodnim oblicima elemenata jednak je broj svakog u atomu To znači da su elementi električno neutralni jer se naboji iz protona i elektrona međusobno otkazuju.
Ion je nabijeni atom.Ako atom dobije elektron, negativni naboj nadmašuje pozitivni naboj, a cijeli atom dobiva negativan naboj. Ti se ioni nazivaju anionima. Ako atom izgubi elektron, tada postoji pozitivniji naboj od negativnog naboja, a atom u cjelini postaje pozitivno nabijeni ion. To se naziva kation.
Kako se formiraju kationi?
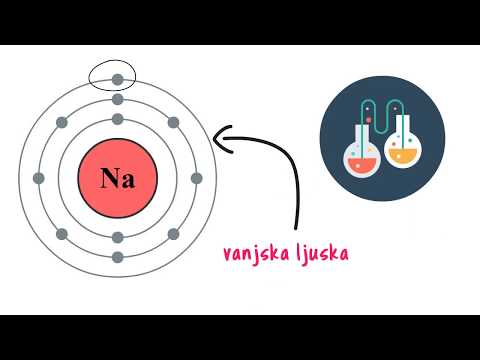
Kationi nastaju kada neutralni atom izgubi elektron. Metali su skloni gubitku elektrona kao rezultat rasporeda elektrona oko jezgre. Elektroni zauzimaju različite orbitale oko jezgre, a oni se mogu grupirati u različite razine energije. Elektroni u orbiti s visokom razinom energije udaljeniji su od jezgre. Atomi s potpunom razinom vanjske energije su stabilni, ali ako je u vanjskoj energetskoj razini mali broj elektrona, skloni su gubitku elektrona. Elektroni u razinama punih energije „štite“ od pozitivnog naboja jezgru. Kao rezultat toga, vanjski elektroni su samo slabo vezani za jezgro.
Kationi nastaju procesom ionizacije kada se daje dovoljno energije elektranu (na primjer, svjetlošću dovoljno velike energije) da ga se odstrani od privlačenja jezgre. Energija potrebna za to naziva se energijom ionizacije. Prva energija ionizacije govori koliko energije vam je potrebno za uklanjanje jednog elektrona; druga ionizacijska energija govori koliko vam je potrebno za uklanjanje druge i tako dalje.
Naboje na rezultirajućem ionu možete izračunati na temelju grupe periodične tablice u kojoj je element. Na primjer, natrij je u grupi 1, a on tvori kation s nabojem +1. Magnezij je u skupini 2 i formira kation s nabojem +2 nakon što je dva iona elektrona izgubila na ionizaciji. Aluminij je u skupini 3 i tvori kation +3. Elementi grupe 4 ne tvore ione, a elementi više grupe umjesto toga oblikuju anione.
Kako se formiraju anioni?
Anioni nastaju suprotno procesu kationa. Umjesto da izgube elektron, nemetalni atomi mogu dobiti elektron. To je zato što je njihova vanjska razina energije gotovo puna. Pojam afinitet elektrona opisuje tendenciju da neutralni atomi dobivaju elektrone. Kao i energija ionizacije ima jedinice energije, ali za razliku od energije ionizacije ima negativnu vrijednost jer se energija oslobađa kada se dodaju elektroni, dok se apsorbira kada se elektroni uklone.
Općenito, elementi u višim skupinama (oni koji su desno na periodičnoj tablici) imaju veće afinitete elektrona, a elementi u višem redu svojih skupina (dalje prema vrhu periodičke tablice) imaju veće afinitete elektrona. Smanjenje afiniteta elektrona dok se krećete niz određeni stupac povezano je s povećanom udaljenosti između vanjskih ljuski i jezgra, kao i zaštitom od ostalih elektrona u nižim razinama energije. Povećavanje afiniteta kad se pomičete s lijeva na desno je zato što se razine energije približavaju punoj zauzetosti.
Što se tiče kationa, grupa elementa vam govori s koliko će naboja odgovarati anion. Naplaćeni naboj je grupni broj minus osam. Klor, u grupi 7, tvori anion s -1 nabojem, a kisik, u skupini 6, tvori kation s nabojem -2.